Borges e Nicolau
Gás ideal ou gás perfeito
No estudo do comportamento de um gás, consideramos o seguinte modelo:
• as moléculas do gás movimentam-se caoticamente;
• os choques entre as moléculas e contra as paredes do recipiente são perfeitamente elásticos;
• as moléculas não exercem forças entre si, exceto quando colidem;
• as moléculas apresentam volume próprio desprezível em comparação com o volume ocupado pelo gás.
O gás que obedece a este modelo é chamado gás perfeito ou gás ideal.
Um gás real submetido a altas temperaturas e baixas pressões apresenta um comportamento que se aproxima ao de um gás ideal.
Variáveis de estado
São as grandezas que caracterizam o estado de uma dada massa de gás perfeito:
Volume (V): o volume de um gás perfeito é o volume do recipiente que o contém.
Unidades: m3, litro (L), cm3.
Relações: 1 m3 = 1000 L, 1 m3 = 106 cm3, 1 L = 1000 cm3.
Pressão (p): a pressão de um gás perfeito resulta do choque de suas moléculas contra as paredes do recipiente que o contém. Sendo F a intensidade da força resultante que as moléculas exercem numa parede de área A, a pressão p é a grandeza escalar p = F/A.
Unidades: 1 pascal (Pa) = 1N/m2, atmosfera (atm); mmHg.
Relações: 1 atm = 105 Pa; 1 atm = 760 mmHg.
Temperatura (T): É a grandeza que mede o estado de agitação das moléculas do gás. No estudo dos gases utiliza-se a temperatura absoluta kelvin (K).
Transformações particulares
a) Isobárica: pressão p constante
Variam durante a transformação: o volume V e a temperatura T.
• Lei de Charles e Gay-Lussac da transformação isobárica:
Numa transformação isobárica, de uma determinada massa gasosa, o volume V e a temperatura T são diretamente proporcionais.
V = K.T ou V/T = K (constante)
• Mudança do estado V1, p e T1 para V2, p e T2
V1/T1 = V2/T2
• Gráfico V x T
Clique para ampliar
b) Isocórica: volume V constante.
Variam durante a transformação: a pressão p e a temperatura T.
• Lei de Charles e Gay-Lussac da transformação isocórica:
Numa transformação isocórica de uma determinada massa gasosa, a pressão p e a temperatura T são diretamente proporcionais.
p = K.T ou p/T = K (constante)
• Mudança do estado V, p1 e T1 para V, p2 e T2
p1/T1 = p2/T2
• Gráfico p x T
Clique para ampliar
c) Isotérmica: temperatura T constante
Variam durante a transformação: a pressão p e o volume V
• Lei de Boyle - Mariotte
Numa transformação isotérmica, de uma determinada massa gasosa, a pressão p e o volume V são inversamente proporcionais.
p = K/V ou p.V = K (constante)
• Mudança do estado V1, p1 e T para V2, p2, T
p1.V1 = p2.V2
• Gráfico p x V (hipérbole equilátera)
Clique para ampliar
Exercícios básicos
Exercício 1:
Um gás perfeito sofre uma transformação isobárica e seu volume varia de V1 para V2 enquanto que sua temperatura varia de T1 para T2. Relacione as grandezas V1, V2, T1 e T2.
Resolução:
Sendo a transformação isobárica, de uma determinada massa gasosa, o volume V e a temperatura T são diretamente proporcionais.
V = K.T ou V/T = K (constante). Portanto: V1/T1 = V2/T2
Resposta: V1/T1 = V2/T2
Exercício 2:
Um gás perfeito sofre uma transformação isocórica e sua pressão varia de p1 para p2 enquanto que sua temperatura varia de T1 para T2. Relacione as grandezas p1, p2, T1 e T2.
Resolução:
Sendo a transformação isocórica, de uma determinada massa gasosa, a pressão p e a temperatura T são diretamente proporcionais.
p = K.T ou p/T = K (constante). Portanto: p1/T1 = p2/T2
Resposta: p1/T1 = p2/T2
Exercício 3:
Um gás perfeito sofre uma transformação isotérmica e sua pressão varia de p1 para p2 enquanto que seu volume varia de V1 para V2. Relacione as grandezas p1, p2, V1 e V2.
Resolução:
Sendo a transformação isotérmica, de uma determinada massa gasosa, a pressão p e o volume V são inversamente proporcionais.
p = K/V ou p.V = K (constante). Portanto: p1.V1 = p2.V2
Resposta: p1.V1 = p2.V2
Exercício 4:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a temperatura TB.
Resolução:
a) Do gráfico concluímos que o volume V e a temperatura T são diretamente proporcionais. Logo, a transformação é isobárica,
b) VA/TA = VB/TB => 20/300 = 60/TB => TB = 900 K
Respostas: a) isobárica; b) 900 K
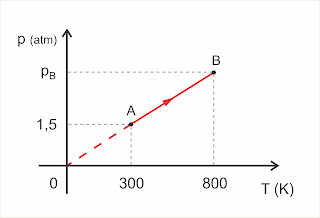
Exercício 5:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a pressão pB.
Resolução:
a) Do gráfico concluímos que a pressão p e a temperatura T são diretamente proporcionais. Logo, a transformação é isocórica.
b) pA/TA = pB/TB => 1,5/300 = pB/800 => pB = 4 atm
Respostas: a) isocórica; b) 4 atm
Exercício 6:
O gráfico representa uma transformação AB sofrida por um gás perfeito.
Clique para ampliar
a) Qual é o tipo de transformação que o gás está sofrendo?
b) Determine a pressão pA
Resolução:
a) Do gráfico concluímos que a pressão p e a temperatura T são inversamente proporcionais. Logo, a transformação é isotérmica
b) pA.VA = pB.VB => pA.200 = 1,0.600 => pA = 3,0 atm
Respostas: a) isotérmica; b) 3,0 atm
Exercício 7:
Um gás perfeito sofre uma transformação cíclica ABCA, indicada no diagrama p x V.
Clique para ampliar
Classifique o tipo de transformação sofrida pelo gás nas etapas:
a) A para B
b) B para C
c) C para A
Resolução:
a) A -> B: pressão constante -> isobárica
b) B -> C: volume constante -> isocórica
c) C -> A: temperatura constante -> isotérmica
Respostas:
a) A para B: isobárica
b) B para C: isocórica
c) C para A: isotérmica






Nenhum comentário:
Postar um comentário